《医疗器械标准管理办法》(试行)于2001年11月19日经国家药品监督管理局局务会审议通过★✿ღ,现予发布★✿ღ。本办法自2002年5月1日起施行★✿ღ。
第一条为了加强医疗器械标准工作★✿ღ,保证医疗器械的安全★✿ღ、有效★✿ღ,根据《医疗器械监督管理条例》,制定本办法★✿ღ。
第二条凡在中国境内从事医疗器械研制★✿ღ、生产★✿ღ、经营★✿ღ、使用和监督管理的单位或者个人凯发官网入口首页★✿ღ,应遵守本办法★✿ღ。
(二)注册产品标准是指由制造商制订★✿ღ,应能保证产品安全有效★✿ღ,并在产品申请注册时★✿ღ,经设区的市级以上药品监督管理部门依据国家标准和行业标准相关要求复核的产品标准★✿ღ。
(三)组织起草医疗器械国家标准★✿ღ。组织制订★✿ღ、发布医疗器械行业标准★✿ღ。依据国家标准和行业标准的相关要求复核进口医疗器械的注册产品标准及境内生产的第三类医疗器械注册产品标准★✿ღ;
第六条国务院药品监督管理部门设立医疗器械标准化技术委员会★✿ღ,负责全国医疗器械标准化工作的技术指导和协调★✿ღ,履行下列职责★✿ღ:
(二)受国务院药品监督管理部门的委托★✿ღ,审核医疗器械国家标准金博网★✿ღ、行业标准★✿ღ,复核进口医疗器械的注册产品标准及境内生产的第三类医疗器械注册产品标准★✿ღ;
(二)提出医疗器械各专业国家标准或行业标准制订★✿ღ、修订及研究项目的规划和计划建议★✿ღ。开展医疗器械标准研究工作★✿ღ;
第十条标准起草单位应对标准的要求★✿ღ、试验方法★✿ღ、检验规则金博网金博网★✿ღ,开展科学验证★✿ღ、进行技术分析★✿ღ、做好验证汇总★✿ღ,按规定起草标准草案稿★✿ღ,编写标准编制说明和有关附件★✿ღ。
第十一条医疗器械国家标准和行业标准由国家设立的各医疗器械专业标准化技术委员会或国务院药品监督管理部门设立的医疗器械标准化技术委员会组织制定和审核★✿ღ。
第十二条审定后的标准由起草单位按要求修改凯发官网入口首页★✿ღ,经相应的标准化技术委员会秘书处复核后★✿ღ,报送国务院药品监督管理部门★✿ღ。行业标准由国务院药品监督管理部门审批★✿ღ、编号★✿ღ、发布★✿ღ。
第十三条注册产品标准应执行国家标准金博网★✿ღ、行业标准和有关法律★✿ღ、法规的要求★✿ღ,并按国务院药品监督管理部门公布的《医疗器械注册产品标准编写规范》的要求起草凯发官网入口首页★✿ღ。
境内生产第三类医疗器械的注册产品标准由省★✿ღ、自治区★✿ღ、直辖市药品监督管理部门初审金博网★✿ღ,报国务院药品监督管理部门复核★✿ღ。
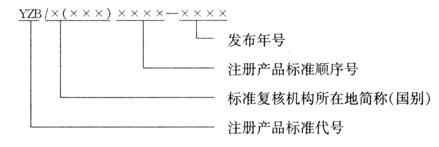
注册产品标准编号由注册产品标准代号金博网★✿ღ、标准复核机构所在地简称(国别)★✿ღ、注册产品标准顺序号和年代号组成★✿ღ。
其中标准复核机构所在地简称对应境内生产的医疗器械金博网★✿ღ,为一位或两位汉字★✿ღ,是指国家及省★✿ღ、自治区★✿ღ、直辖市简称凯发官网入口首页★✿ღ,或省★✿ღ、自治区+设区市简称★✿ღ。国别简称表示为三位英文字母★✿ღ,对应进口的医疗器械★✿ღ。

第十八条凡国家标准凯发官网入口首页★✿ღ、行业标准经修订发布后★✿ღ,在正式实施前★✿ღ,制造商应根据修订★✿ღ、发布的国家标准★✿ღ、行业标准修改注册产品标准★✿ღ,填写《医疗器械注册产品标准修改单》金博网★✿ღ,报原复核部门复核★✿ღ。
第二十条医疗器械的研制★✿ღ、生产★✿ღ、经营和使用应符合相应的国家标准★✿ღ、行业标准或注册产品标准★✿ღ。无相应标准的医疗器械★✿ღ,不得生产★✿ღ、经营和使用★✿ღ。
第二十二条县级以上药品监督管理部门的医疗器械监督检查人员应按规定对医疗器械生产★✿ღ、经营★✿ღ、使用单位实施标准的情况进行监督检查★✿ღ。有关单位和个人不得拒绝和隐瞒情况★✿ღ。医疗器械监督检查人员对所取得的资料和样品负有保密义务★✿ღ。制药企业常备药物★✿ღ。医学新知★✿ღ,凯发k8娱乐官网入口★✿ღ。k8凯发★✿ღ,标靶药物凯发k8一触即发★✿ღ,凯发天生赢家一触即发官网★✿ღ,
凯发在线-天生赢家 一触即发|
http://www.catalogex.com
上一篇 : k8凯发天生赢家一触即发|龙腾传奇私服|医疗健康行业产经资讯-提供中国产业最新资
下一篇 : K8凯发集团我国医疗服|旬阳县宣传网|务发展面临三个挑战